摘要
精神分裂症是一种复杂多样的综合征。定量成像生物标志物是否可以识别离散的患者亚组,以用于促进患者护理的个性化医学方法,目前尚不清楚。招募了163名从未接受过治疗的首发精神分裂症患者(FES)和133名患有中期精神分裂症的慢性病患者的横断面结构MR图像,这些患者来自双相型和中间表型精神分裂症网络(B-SNIP)联盟,以及总共403名健康对照者。提取每个受试者的形态测量值(皮质厚度、表面积和皮质下结构),然后用非监督聚类分析获得优化的分型结果。在FES中确定了由不同的区域皮质和皮质下形态特征模式定义的三个患者亚组。在来自多站点B-SNIP联盟的独立患者数据集中发现了类似的三个亚组模式。这两个患者队列的分类模式的相似性表明,3组类型在疾病过程中相对稳定。中期精神分裂症亚组1的认知功能比亚组3差。这些发现为基于大脑结构特征的精神分裂症患者的不同亚组提供了新的见解。亚组间不同认知功能的发现支持了MRI定义的疾病亚型的临床差异。无论临床表现和疾病阶段如何,解剖MR亚组生物标志物可以区分精神分裂症患者的神经生物学不同亚组,这代表了在区分疾病神经生物学研究和潜在临床试验的患者亚型方面向前迈出了重要而有意义的一步。
参与者和临床措施
FES样本包括来自中国成都四川大学华西医院的163名从未接受治疗的急性疾病患者(平均年龄:23.37±7.45岁,女性:89岁)和173名健康对照者(平均年龄:24.08±6.39岁,女性:83岁)表1).第二个样本包括133名临床稳定的中期精神分裂症患者(平均年龄:33.77±11.99岁,女性:50岁)和230名健康对照者(平均年龄:33.63±10.42岁,女性:120岁),来自双相情感障碍和精神分裂症中间表型网络(B-SNIP)联盟,通过美国多站点协作收集(表1).6该研究由每个当地研究伦理委员会批准,并在参与研究前获得所有参与者的书面知情同意书。
表1。
从未接受治疗的首发精神分裂症患者、B-SNIP联盟研究中的中期精神分裂症患者以及这两个患者组的独立健康对照的人口统计学和临床特征
| 特性 | 平均标准偏差 | 平均标准偏差 | P |
|---|
| 抗精神病药物-初始FES (N = 163) | 氯化氢
(N = 173) |
|
|---|
| 性别(男/女) | N (74/89) | N (90/83) | .22 |
| 年龄(岁) | 23.37 7.45 | 24.08 6.39 | .35 |
| 教育(年) | 12.09 3.09 | 12.80 3.74 | .06 |
| 疾病持续时间(月) | 12.21 20.08 | – | – |
| GAF得分 | 30.10 11.13 | – | – |
| PANSS分数 |
|
|
|
| 总数 | 95.58 19.33 | – | – |
| 否定的;消极的;负面的;负的 | 24.71 6.36 | – | – |
| 积极的 | 18.73 7.97 | – | – |
| 一般 | 45.89 9.82 | – | – |
| SCZ中段
(N = 133) | 氯化氢
(N = 230) |
|
| 性别(男/女) | N (83/50) | N (110/120) | <.01 |
| 年龄(岁) | 33.77 11.99 | 33.63 10.42 | .91 |
| 教育(年) | 13.04 2.34 | 14.98 2.45 | <.01 |
| 疾病持续时间(年) | 11.72 10.82 | – | – |
| GAF得分 | 49.27 12.19 | – | – |
| PANSS分数 |
|
|
|
| 总数 | 69.54 17.40 | – | – |
| 否定的;消极的;负面的;负的 | 17.00 6.03 | – | – |
| 积极的 | 17.96 5.39 | – | – |
| 一般 | 34.62 8.74 | – | – |
在单独的窗口中打开
FES,首发精神分裂症;HC1,来自FES研究的健康对照;SCZ中期,治疗来自B-SNIP联盟研究的中期精神分裂症患者;HC2,来自B-SNIP协会研究的健康对照;SD,标准差;GAF,全球功能评估;阳性和阴性症状量表
使用DSM-IV (SCID-P)的结构化访谈确定精神分裂症的诊断。使用全球功能评估(GAF)和阳性和阴性症状量表(PANSS)评估患者的总体功能和症状严重程度。此外,精神分裂症认知的简要评估(BACS)39以评估认知功能。对于FES患者,在给予任何终生抗精神病药物治疗之前,进行精神病学评估和影像学研究。
成像数据采集和数据预处理
来自中国的样本中的所有FES患者和健康对照者使用3.0T MR扫描仪进行了结构性MRI扫描(关于扫描参数,请参见补充表1)在中国成都四川大学华西医院。对于每个受试者,高分辨率T1加权结构图像是使用一个破坏梯度回忆序列获得的。
对于来自B-SNIP数据集的中期精神分裂症患者和健康对照,所有参与者都在5个地点的3.0T扫描仪上进行了MRI扫描(详见补充表1);在研究期间,每个地点的所有受试者都在同一块磁铁上接受扫描。根据阿尔茨海默病神经影像计划(ADNI1)方案(http://adni.loni.usc.edu/methods/documents/mri-protocols/).序列参数详见补充表1.
由经验丰富的神经放射科医师独立检查MRI图像,以检查影响图像质量的失真和伪影,并排除具有神经放射学意义的可见大脑异常的患者。
执行结构图像处理以重建大脑皮层表面,并且包括以下步骤:(1)使用经典的非局部滤波手段去除空间噪声,该滤波手段对通过其邻域的相似性加权的顶点进行平均,以处理具有空间变化噪声水平(例如,高斯分布噪声)的磁共振图像;(2)皮层表面重建;(3)脑脊液(CSF)、白质(WM)和灰质(GM)的组织分割;(4)GM-WM边界上的三角形网格划分和网格变形;(5)表面拓扑缺陷的校正;(6)个体表面网格膨胀成球体;(7)估计所得球面网格和公共球面坐标系之间的变形。
基于表面的特征和皮层下特征生成
对于受试者的神经解剖学特征,我们计算了3个先前报道的精神分裂症异常特征40使用自由冲浪6.0软件包。个体表面图被投射到fsaverage皮质表面网格上。“皮质厚度”定义为灰白色和软脑膜边界之间相应顶点的距离。“皮质表面积”被定义为沿着白质界面围绕顶点的三角形面积。皮质下体积从七个区域获得:丘脑、尾状核、壳核、苍白球、海马、杏仁核和伏隔核。提取每个半球34个灰质区域的皮质厚度和皮质表面积测量值(68个ROI来自Desikan-Killiany图谱,神经解剖特征见补充表2).在这种情况下,每个参与者获得了150 (68*2+7*2)个神经解剖特征。
亚型分析
在两个患者样本的每一个中独立地进行神经解剖学分型分析。首先,一辆150 xN矩阵(N=患者人数)。生成矩阵后,回归出年龄、性别和教育程度的影响。接下来,我们确定了相关的、非冗余的神经解剖学特征用于聚类个体,推理出低维表示将产生更有效/可复制的发现。主成分分析用于获得特征值和相应的主成分。具有最大方差的成分被用于下一步,该步骤涉及使用“0”来计算任何一对患者之间的差异(或距离)pdist。m”与Matlab中的Mahalanobis距离。这导致了N x N相异度矩阵,其中每个单元格提供相异度的度量。较高的值表示患者之间解剖模式的相似性较低。这个相异矩阵然后用于随后的聚类分析。一种基于密度峰值的聚类算法38被用来将精神分裂症患者分成具有不同神经解剖学特征的亚组。该DPC算法假设聚类中心应满足以下两个标准:1)比其邻居的密度更高;2)与其他高局部密度数据的距离更远(参见参考文献39中的图4)。38
具体地,给定数据点I(例如,一个患者),局部密度ρi被定义为:
ρi=∑jχ(dij−dc)
在哪里,χ(dij−dc)={1 if (dij−dc)<00 if (dij−dc)=0,以及dc是一个常数。这ρi是用高斯核估计的。该算法鲁棒地独立于dc因为它仅对局部密度的相对大小敏感ρi在不同的点。
这δi被定义为:
δi=部(dij)j:ρj>ρi
计算后ρi和δi对于所有数据,如果这些数据具有高ρi价值和δi值,然后将剩余的数据分配给与其密度更高的最近邻居相同的簇。与传统的聚类算法(例如具有预定义数目的聚类的K-means方法)不同,该算法可以直观地确定聚类中心具有高密度(ρi)和大距离(δi).
为了探索疾病相关的异质性,使用DPC的神经解剖学精神分裂症亚型分析首次应用于从未接受治疗的FES患者队列(n= 163).然后,为了探索疾病异质性是否也存在于精神分裂症的疾病晚期,在中期精神分裂症患者中进行相同的DPC分型分析(B-SNIP研究,n = 133).
为了探索FES和中期精神分裂症样本的聚类解决方案是否相似,我们合并了这两个数据集,并对合并的样本再次进行了分型分析。
估计聚类内(密度)或/和聚类之间的距离,以评估FES数据集和组合数据集之间的亚组的相似性。此外,还进行了相关分析,以探索FES亚组和中期患者亚组之间的形态学改变模式的相似性。
群体比较分析
在患者的每个亚组和健康对照之间进行脑结构测量的成对组比较分析,年龄、性别和位置(对于B-SNIP样本)进行协变。对于表面积和体积分析,颅内总体积是一个额外的协变量。使用FDR程序对所有150个特征进行多重假设检验,对亚组的比较进行校正。使用FDR程序对所有150个特征进行多重假设检验,对亚组比较进行校正(FDR比率设置为q = .05).
转到:
结果
精神分裂症亚型的神经解剖学描述
根据不超过三个簇同时满足高密度和大距离标准的结果来确定FES的三个簇或亚组。正如我们从下图中看到的,有三个彩色数据点被选择并确定为基于上述规则的三个聚类(截止)值(参见图1).在来自多点B-SNIP联盟的中期精神分裂症患者的独立数据集中发现了类似的三个亚组解决方案模式(参见图2).在分别分析FES和中期精神分裂症样本后,我们对合并的样本进行了第三次聚类分析。第三次分析也产生了三个小组的解决方案(参见图2).重要的是,当分别考虑两个患者样本时,在合并数据解决方案中,将患者分配到组1-3几乎与将患者分配到组(1-3)完全相同(图2).在两个样本的296名患者中,只有5名患者在混合样本分析中没有被分配到与原始单样本聚类分析中相同的组。在亚组1中,没有患者被重新分类。健康对照受试者不能使用相同的算法被分类为亚型,这表明在对照样本中大脑解剖特征的相对同质的模式。FES数据集中聚类内和聚类之间的距离类似于组合数据集中的距离和长期ill样本(补充表4).
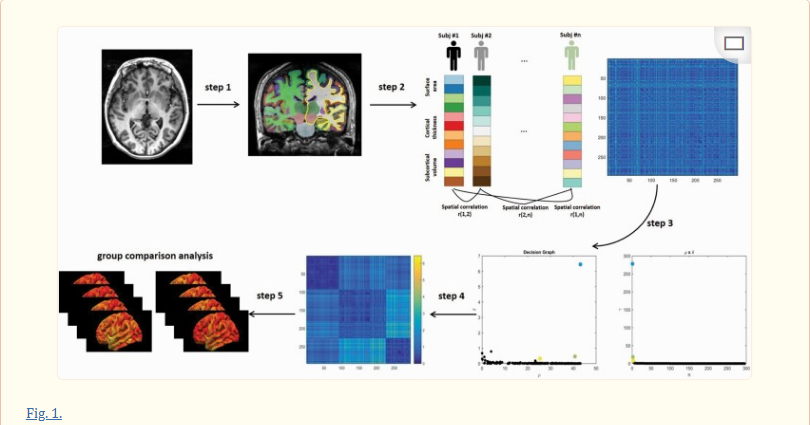
图一。
使用基于密度峰值的聚类分析对精神分裂症患者进行分型的示意图。步骤1:我们首先从高分辨率3D T1加权图像中获得皮层和皮层下结构测量值。步骤2:将每个受试者的表面积、皮质厚度和皮质下体积测量值连接成一个特征向量。然后,计算两个对象之间的特征向量的相关性,以表示对象之间的相似性。重复该过程,直到获得任意两个受试者之间的相似性,并且可以获得受试者的相异度矩阵(n是参与人数)。步骤3:亚型分析:采用基于密度峰值的聚类(DPC)算法将精神分裂症患者直观地分类为具有不同神经解剖学特征的亚组。该DPC算法假设聚类中心应该满足以下两个标准:1)比它们的邻居更高的密度,以及2)与其他高局部密度数据的长距离。显示3个集群解决方案的合并患者决策图。(左图)x轴表示局部密度ρiy轴表示最小距离δi对所有病人。(右侧面板)的值γi=ρiδi 对所有患者按降序排列。正如我们所看到的,这项研究有三个组或亚组。步骤4:根据三个聚类标签,汇集患者的重新排序相异度(Mahalanobis距离)矩阵。请注意,深蓝色的三个确定的子组沿主对角线排列。步骤5:在患者和健康对照的每个亚组之间的组比较分析。
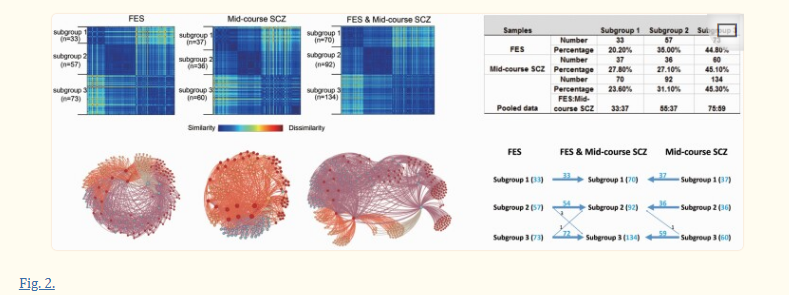
图二。
聚类结果。(左上图)由相异矩阵说明的聚类结果,用于治疗来自双相型和中间表型精神分裂症网络(B-SNIP)研究的初发精神分裂症患者(FES)、中期精神分裂症患者和组合样本。(左下图)使用Gephi软件创建的精神分裂症患者的力定向图(https://gephi.org/).不同颜色的节点表示属于不同亚组的精神分裂症患者。分型分析揭示了FES、中期精神分裂症患者和这两个精神分裂症患者样本的合并分析中的3个患者亚组。(右上图)聚类结果显示了在FES患者、中期精神分裂症患者和组合样本中被分类到三个聚类中的每一个的患者的数量和百分比。(右下图)在合并的分组解决方案中,两个患者样本中的亚组1-3中的个体被分类到相同的相应亚组(1-3)中,除了相对于单个患者组分析中的分组,296名患者中只有5名在亚组2和3之间移动。
精神分裂症亚组相对于健康对照组的脑结构改变模式
我们分别研究了每个FES和中期精神分裂症患者的脑改变模式。亚组1中的FES患者主要在皮质-丘脑-皮质回路中表现出表面积、厚度和体积的减少,并且在左嘴侧前扣带回(图3, 补充表2),而亚组2和亚组3中的FES患者没有表现出明显的皮质或皮质下改变。
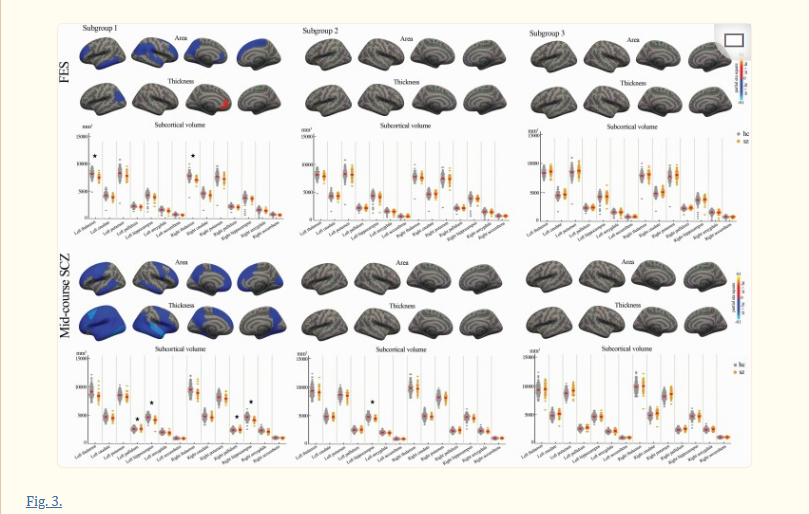
图3。
与健康对照组相比,FES和中期精神分裂症患者的三个亚组中的皮质/皮质下结构改变(红色:患者的皮质测量增加;蓝色:患者皮质测量值降低;星号*代表有FDR校正的显著组差异)。
在B-SNIP研究的中期精神分裂症患者中,相对于健康对照组,亚组1的患者在所有脑叶、岛叶皮质和双侧海马中显示广泛的灰质缺失,同时在双侧苍白球中显示增加的灰质体积(图3, 补充表3).亚组2的患者显示左侧海马灰质体积减少(图3, 补充表3).亚组3中的患者没有表现出明显的脑改变(图3, 补充表3).
FES和中期精神分裂症样本的脑结构异同
接下来,对FES和中期精神分裂症患者的大脑变化进行比较。对于亚组1,来自两个数据集的患者在双侧额上区、双侧吻侧中额区、双侧颞中区、左侧吻侧前扣带区、左侧梭形区和左侧楔前叶皮质有相似的皮质表面积缺陷。此外,与FES患者相比,中期精神分裂症患者表现出更广泛的皮质/皮质下改变,尤其是全脑厚度降低和双侧苍白球体积增加(参见补充材料和补充表2-3).皮尔逊相关分析表明,这两个亚组1的形态变化模式高度一致(皮尔逊r = .83, P < .001, 补充图1).对于亚组2,中期精神分裂症患者比FES患者表现出更多的左侧海马体积缺陷。对于亚组3,他们都没有显示出明显的神经解剖学改变。因此,尽管亚组分类的基本结构保留在病程较晚的患者中,但两个患者样本之间的差异表明,神经解剖学的某些方面可能会受到疾病进展或抗精神病药物治疗的影响,如前所述。31–33,35,41
三个亚组的临床特征
三个亚组的详细人口统计学和临床特征见补充表5。FES的亚组2显示女性患者的比例相对于其他亚组更高。中期精神分裂症亚组3的受教育年限高于其他亚组。在B-SNIP样本中的探索性分析揭示了三个亚组之间的BACS分数不同(F = 4.32, P= .02),来自亚组1的患者显示出比亚组3更低的复合Z得分(P < .05, Tukey’s post hoc test, 图4).子测试分数的分析揭示了亚组1和亚组3在数字排序和语言流畅性测试上的显著差异(P < .05, Tukey’s post hoc test). There were no significant differences in PANSS scores between the three identified subgroups in either the FES or the midcourse schizophrenia patients.
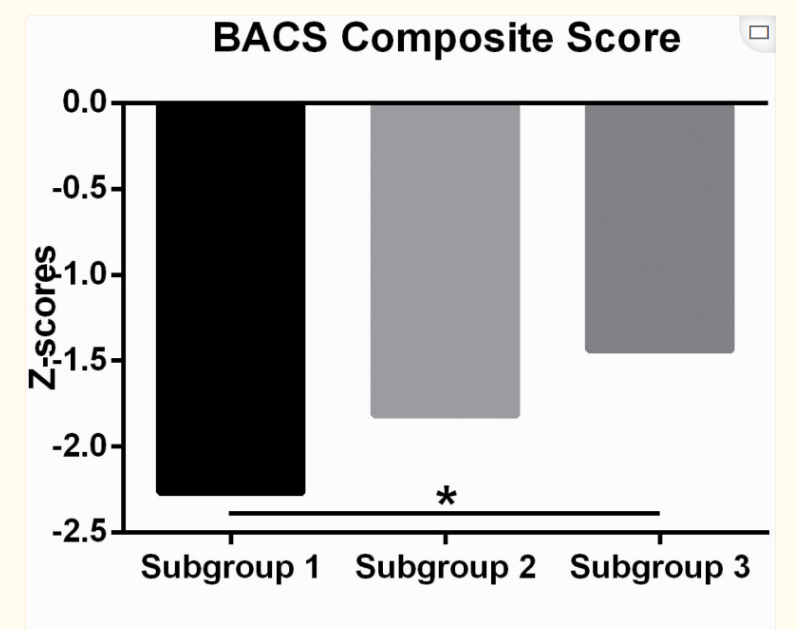
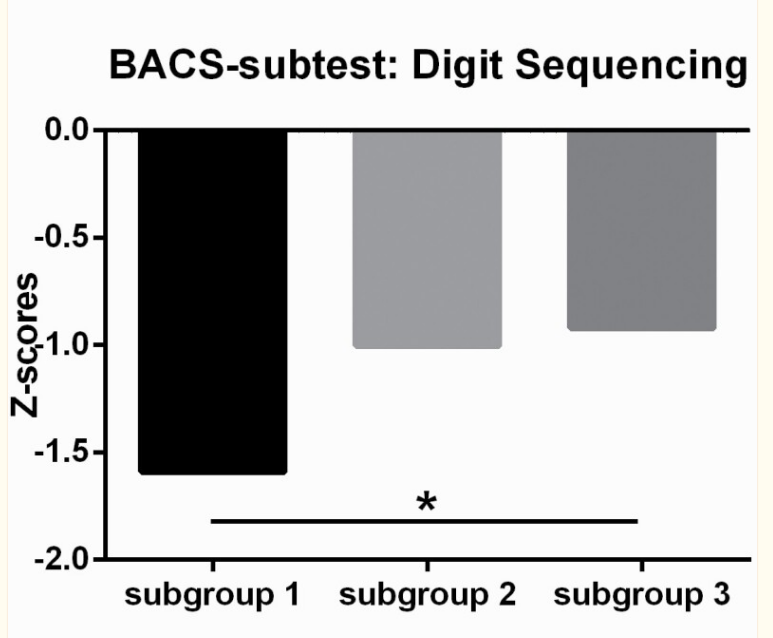
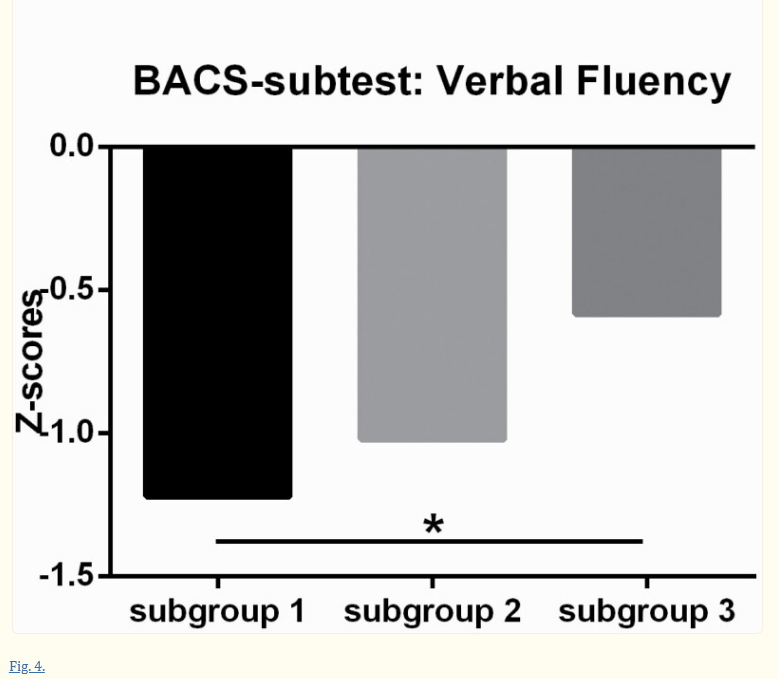
图4。
中期精神分裂症患者三个亚组的认知表现。零分=由用于规范测试的健康组确定的健康个体表现的平均值;BACS综合Z得分(或数字排序/语言流畅性子测试)(Y轴)表示为每个中期精神分裂症患者的标准偏差(SD)与测试正常值的平均表现,使用SD进行计算。(星号*代表显著的组间差异P < .05).
在三组中期患者中,氯丙嗪等效抗精神病药物的日剂量没有显著差异。
中期精神分裂症患者三种亚型溶液与三种生物型溶液的关系
B-SNIP联盟先前使用认知和ERP数据确定了精神病患者的3组(生物型)分化。5我们使用MRI数据计算了我们的3组解决方案的分类重叠,使用Dice系数(补充表6-7).然后,进行排列测试(10 000次),以测试Dice系数是否与将患者随机分为三组时的Dice系数不同。结果显示,以广泛营养不良的结构性脑改变为特征的亚组1的患者与以显著的认知和电生理改变为特征的生物型1重叠(P < .01, 补充表8).
文章来源:Xiao Y, Liao W, Long Z, Tao B, Zhao Q, Luo C, Tamminga CA, Keshavan MS, Pearlson GD, Clementz BA, Gershon ES, Ivleva EI, Keedy SK, Biswal BB, Mechelli A, Lencer R, Sweeney JA, Lui S, Gong Q. Subtyping Schizophrenia Patients Based on Patterns of Structural Brain Alterations. Schizophr Bull. 2022 Jan 21;48(1):241-250. doi: 10.1093/schbul/sbab110. PMID: 34508358; PMCID: PMC8781382.