精神分裂症是最严重的精神疾病之一,以一系列临床综合征为特征,包括认知、思维、情绪和行为的异常。2013年,精神分裂症在《精神障碍诊断与统计手册》第五版(DSM-5)中首次以谱系障碍分类,由分裂样障碍、妄想、精神分裂症样障碍、精神分裂症和分裂情感性障碍组成。这清楚地让我们认识到精神分裂症谱系障碍的复杂性。在临床实践中,精神分裂症是调查最多的类型,导致高残疾和社会负担。为了更好地了解这种疾病的发病机制并开发有效的治疗方法,已经提出了其一些表型作为症状的类别,包括偏执型、青春年少型、紧张型、未分化型和直截了当型。另一个系统将精神分裂症分为两种类型,I型和II型,以阳性和阴性症状为特征。一般来说,一个相关的假说支持精神分裂症的相应表型,如I型和II型精神分裂症患者的多巴胺能分歧。1
精神分裂症通常在青年阶段发作,导致生长和发育明显迟缓,从而在余生造成残疾负担。阐明早发性精神分裂症的分子和临床特征至关重要。精神分裂症通常发生在10-30岁之间,而10-20岁和20-30岁分别是两个发病高峰。2一般认为,发病年龄较早(< 20岁)的精神分裂症患者比其他发病年龄的精神分裂症患者具有更严重的症状。3在早发性精神分裂症患者的大脑区域,包括额叶和颞叶,观察到了延迟成熟。4,5除了宏观水平的临床和组织学分析之外,包括基因和相关修饰在内的分子理论可以从早发患者的特殊特征中获得。对于不同发病年龄的精神分裂症患者脑区的成熟分化,精神分裂症的发病机制中可能存在神经发育障碍。6,7
至于人类神经发育过程,叶酸是一种必需物质,可以预防发育障碍,如神经管缺陷。MTHFR是调节叶酸转化和代谢的关键酶,因此有助于叶酸的细胞内生物转化。据报道,特定位点的基因多态性会损害MTHFR的酶活性。精神分裂症的动物模型和临床特征研究表明MTHFR多态性可能与疾病风险的增加和发病年龄的提前有关。8–11然而,一些研究得出结论认为MTHFR多态性不影响精神分裂症风险或发病年龄。12,13尽管之间的结论MTHFR和精神分裂症是不一致的,基因多态性可能有助于不同发病年龄的精神分裂症的特征。除了由基因多态性引起的MTHFR活性的改变,叶酸转化下游的甲基供应受到影响,并且相关的甲基化修饰可能涉及精神分裂症的发作和临床特征。14
我们的研究旨在调查MTHFR早发性精神分裂症患者的多态性和相关甲基化改变,这暗示了精神分裂症的特殊表型(早发性和成人型)。这项研究提供了早发性精神分裂症分子变异的观点,这可能有助于作为该疾病潜在特殊表型的临床判断和治疗。对不同发病年龄的精神分裂症患者进行分子探索的研究很少。在这个过程中,症状的严重程度、MTHFR研究了不同发病年龄的精神分裂症患者基因组和精神分裂症相关基因的多态性和甲基化水平。入选的多态性位点包括C677T (rs1801133)、A1298C (rs1801131)和G1793A (rs2274976)的MTHFR活性和功能相关变体。15–17由于叶酸代谢途径中的基因多态性具有以多位点效应为特征的组合功能,18我们检测了以下基因的单位点和多位点多态性MTHFR。MTHFR叶酸的作用可以通过甲基化修饰过程实现,影响功能基因的表达水平。入选的C677T TT基因型患者(酶活性下降70%)15,16并且选择高阳性和阴性症状量表(PANSS)分数来确定甲基化水平。
材料和方法
学科
所有程序都符合赫尔辛基宣言的最新版本。患者样本来源于北京市精神疾病临床资料和样本数据库。伦理委员会批准了医院的研究项目,并获得了对人体实验的知情同意。在本研究中,从18岁以下入选患者的父母处获得了书面知情同意书。177名精神分裂症患者(114名早发性和59名成人型)平均年龄为24岁。发病年龄定义为首次出现阳性症状,而非阴性症状或其他非精神病性症状。在不同发病年龄的患者中,性别的人口统计学数据没有发现显著差异。入选受试者的人口统计学特征如所示表1.
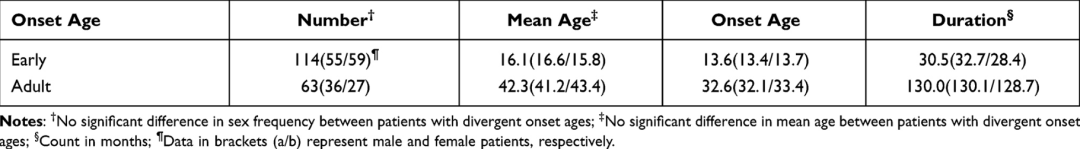
根据DSM-V精神分裂症标准,基于两位经验丰富的医生的判断,对入选患者进行诊断。诊断是基于对2012年12月10日TCH修订的迷你成人的访谈,获得了人口统计学信息和PANSS评分。两名受过训练的精神病住院医师参与了PANSS的评估。他们在一个简短的视频培训项目中接受了培训。参与者根据使用简化阳性和阴性症状访谈(SNAPSI)对患者进行访谈的视频进行基线PANSS评分。随后,所有参与者都接受了连续五周的标准化培训。根据与标准专家评分一致的传统标准和评分者之间的可靠性对结果进行分析。在两周的每周会议后,大约75%的参与者评价了黄金标准的可接受偏差。所有入选受试者均为汉族,且处于稳定期,在过去六个月内无急性发作。排除标准包括:由另一种躯体障碍(神经或非神经系统)引起的精神障碍;除精神分裂症外,与其他精神疾病的联合诊断。
药物治疗是PANSS评分和基因DNA甲基化的重要因素。我们收集了早发和成人发病组中不同抗精神病药物方案的名称和受试者数量(补充表1).然后通过计算每种药物按样本量加权的平均剂量,我们将它们除以加权平均奥氮平剂量,得到奥氮平当量。根据早发组和成人组之间的平均当量剂量的比较,它们之间没有统计学差异(补充表2).至于其他药物,如无抽搐电休克治疗(MECT),这表明两组之间没有统计学差异(补充表3).
年龄是叶酸和同型半胱氨酸浓度的重要影响因素。基因的DNA甲基化也因年龄和抗精神病药物而异。然后,我们进行分析以调整年龄中叶酸、同型半胱氨酸和甲基化水平,以及抗精神病药物中的甲基化水平,考虑早发和晚发精神分裂症。而抗精神病药物或年龄与精神分裂症患者基因组甲基化水平无显著相关性(补充表4).不同发病年龄的精神分裂症患者的基因组甲基化水平与年龄无明显相关性(补充表5),在精神分裂症的早发组和成年组之间没有发现叶酸或Hcy水平的显著差异(补充图1).
外围样本
血样是从医院的精神病科采集的。分离血液成分以获得白细胞和血清。从白细胞中提取DNA样本进行多态性和甲基化分析。除PANSS评分外,还收集了其他信息,包括性别、年龄、发病年龄、病程、家族史和临床总体印象(CGI)。
MTHFR多态性分析
的三个多态位点MTHFR,包括C677T (rs1801133)、A1298C (1801131)和G1793A (rs2274976),在ABI棱镜7500序列检测系统(Applied Biosystems,Foster City,CA,USA)中使用TaqMan荧光探针进行测试。PCR反应条件:25 μL系统的总体积包括探针0.63 μL、TaqMan Universal Master Mix II 12.5μL(DNA聚合酶、尿嘧啶-N糖基化酶、具有dUTP的dNTPs、被动参照、优化的缓冲液组分)、蒸馏水6.87 μL和50 ng基因组DNA。样品在95℃预变性10分钟,在93℃变性35个循环40秒,最后在60℃退火/延伸1分钟。
除了单一地点研究MTHFR多态性,我们还通过计算总的风险等位基因负荷来关注多个位点的影响,这可能是一种更全面的反映MTHFR功能的方法。通过合计三个多态性位点的风险等位基因数,获得总的风险等位基因数以评估每个受试者。我们比较了不同发病年龄组中总体风险等位基因数的不同频率,以确定MTHFR多态性与精神分裂症及相关症状的不同起源。同时,我们探索了甲基化的潜在影响之间的相互作用。MTHFR以及发病年龄。
叶酸和同型半胱氨酸(Hcy)测定
使用Elecsys叶酸III试剂盒和化学发光仪(Cobas 8000-E602,Roche)测试叶酸水平。相比之下,根据制造商的说明,使用Hcy检测试剂盒(Leadmanbio)和化学分析仪(AU5800系列,Beckman Coulter)检测Hcy水平。
基因组DNA甲基化分析
16例TT基因型的精神分裂症患者MTHFR选择C677T和PANSS评分高于60的进行基因组DNA甲基化测定。按照制造商的标准方案,使用DNA甲基化金试剂盒(Zymo Research,USA ),将来自每个样品的约500 ng基因组DNA用于亚硫酸氢钠转化。根据制造商的说明,使用Illumina Infinium人类甲基化850 K BeadChip (Illumina Inc .,USA)评估全基因组DNA甲基化。使用R软件中的ChAMP包分析阵列数据以确定甲基化水平。所有探针的甲基化状态表示为β值,它是甲基化探针强度与总探针强度的比率。患者和对照组之间|δβ|≥0.20且校正P值≤ 0.05的CpG位点被认为是差异甲基化位点。如果δβ≥0.20,则认为CpG位置甲基化过度,如果δβ≤0.20,则认为甲基化不足。比较疾病组和正常组启动子和CpG岛的平均β值。19
基因特异性甲基化分析
精神分裂症相关基因,包括COMT,SLC6A4,NRG1,以及脑源性神经营养因子,我们分析了它们的启动子的六个、四个、七个和六个CpG。通过甲基化修饰、亚硫酸盐修饰的DNA纯化、甲基化特异性PCR和焦磷酸测序分析,对特定位点的DNA甲基化水平进行了定量。使用DNA甲基化试剂盒(Qiagen)进行亚硫酸氢盐处理,通过PSQ分析设计(Qiagen)设计引物。这些基因的测试序列如下:
儿茶酚邻位甲基转移酶:5′-TGCCCGCCGCGCTGCCTGCGCCGGACCGGGGCGGGTC-3′;
SLC6A4:5′-ccccgacacacacacaccgctcaggggaggcggacgcgcgga-3′;
NRG1:5′-CGCTGGGTGGCCGCGGCGGCGACAGC-3′;
脑源性神经营养因子:5′-CCGG cccggctggggacggacgcggtctcgc-3′。
统计分析
使用GraphPad Prism 6.0c、SPSS statistics 24处理数据,并生成图表。这χ2测试用于比较以下方面的差异MTHFR不同发病年龄精神分裂症患者的多态性频率。由于有少于5名受试者的列,使用Fisher精确检验进行分析。对不同发病年龄患者的症状和叶酸水平以及同型半胱氨酸进行单因素方差分析(ANOVA)和事后比较。多元线性回归用于确定多因素对症状的影响。在DMPs的甲基化分析中,在Benjamin和Hochberg的多重检验后,使用经验Bayes和线性回归计算P值和调整P值(FDR)。单因素方差分析用于基因组和基因特异性甲基化分析,而富集分析用于基因本体(GO)分析。这个过程还包含超几何分布和Fisher检验,而相关术语是从GO数据库(http://www.geneontology.org).19
结果和统计分析
发病年龄预测分析
MTHFR不同发病年龄患者的多态性、叶酸和同型半胱氨酸
MTHFR各组基因型分布在Hardy–Weinberg平衡中(p> 0.05)如所示表2。C677T和A1298C多态性之间存在连锁不平衡(R2= 0.20,D' = 1)。由于不同位点的非随机关联,C677T和A1298C在等位基因或基因型频率上可能存在相互作用。然后,我们将重点放在单个和多个站点上MTHFR精神分裂症患者的多态性。对于C677T、A1298C和G1793A,不同年龄组患者的基因型或等位基因频率没有显著差异。性别分层后,这些组中的男性或女性精神分裂症患者表达的基因型或等位基因频率均无显著差异。测试了多态性位点的总风险等位基因数,包括C677T、A1298C和G1793A,以阐明多位点的总风险等位基因负荷。MTHFR多态性。多位点多态性模型的总风险等位基因数范围为0至6,而入选受试者的数量范围为0至3。早发性精神分裂症患者(< 20岁)的总风险等位基因数明显高于其他年龄组。各组间多位点多态性没有性别特异性差异。表2和3显示MTHFR不同年龄组患者的多态性和总风险等位基因数MTHFR分别在精神分裂症患者和对照组中。
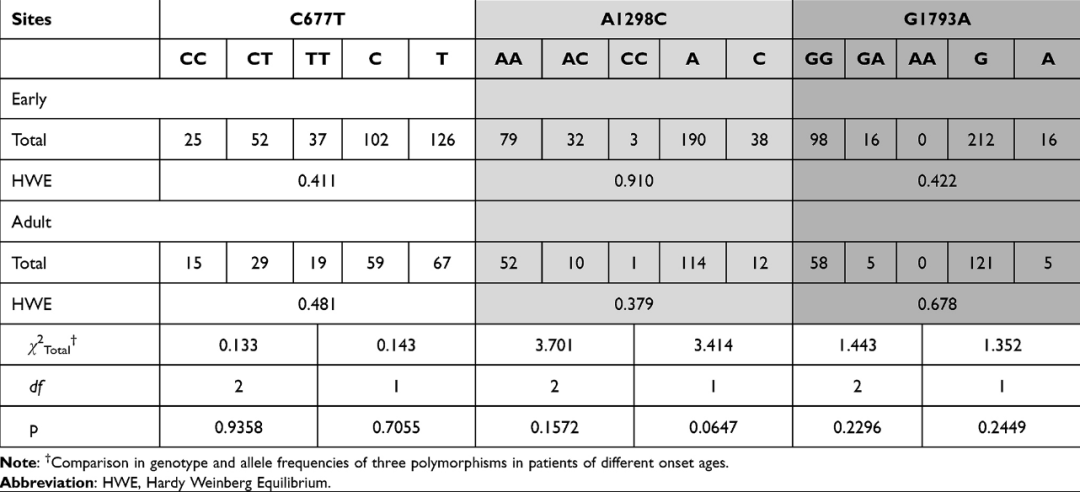
| 表2 MTHFR不同发病年龄患者的多态性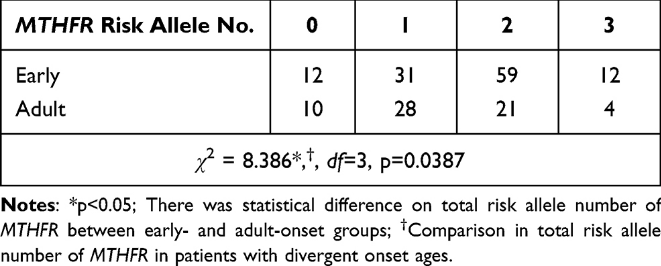 |
| 表3总风险等位基因数MTHFR在早发性和成人型精神分裂症中 |
血清样本用于测定叶酸和同型半胱氨酸水平。结果表明,在不同发病年龄的患者中,这两种物质的水平没有显著差异。
不同发病年龄患者的症状
对患者的PANSS总分、阳性和阴性分数的分析表明,早发性患者相对于其他组的结果表现出显著更高的分数,这与在早发性精神分裂症患者中观察到的更严重的症状一致。对男性和女性患者的亚组分析进一步提供了可比较的结果,即青少年发病伴有更严重的症状。图1显示了早发组与成人发病组的PANSS评分对比。
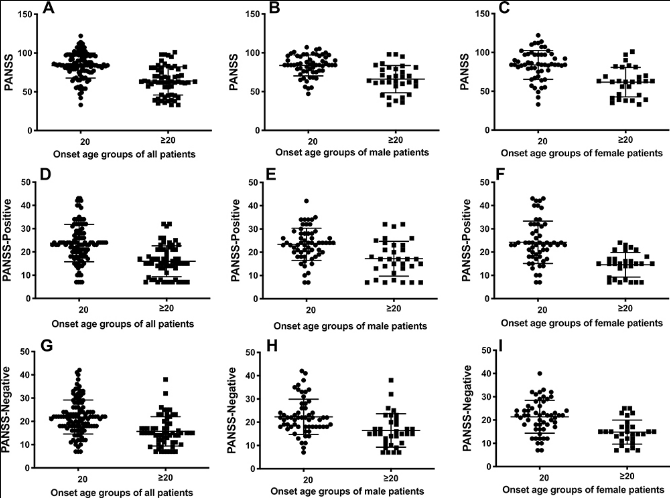
| 图1各组早发年龄(< 20岁)精神分裂症患者的PANSS评分均显著高于成人发病者(p<0.05(A)t(1,176)=7.437,p < 0.0001(B)t(1,176)=5.389,p < 0.0001(C)t(1,176)=5.172,p<0.0001。(D)t(1,176)=6.551,p < 0.0001(E)t(1,176)=3.986,p = 0.0001(F)t(1,176)=5.261,p < 0.0001(G)t(1,176)=5.599,p < 0.0001(H)t(1,176)=3.614,p = 0.0005(I)t(1,176)=4.420,p<0.0001。 |
MTHFR精神分裂症的多态性和症状
PANSS总分、阳性分和阴性分的分析表明,这些分与基因的多位点多态性呈正相关MTHFR,它只出现在早发性精神分裂症患者中,而不是那些发病年龄较晚的患者中。在这个结果中没有观察到性别差异。图2显示了PANSS和之间的相关性MTHFR早发和成人发病组的多态性。
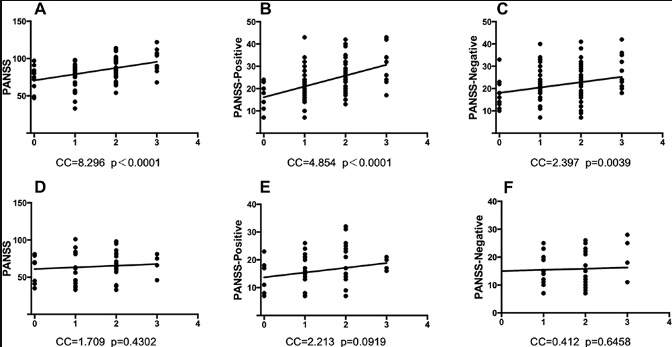
| 图2PANSS评分与精神症状的改善呈正相关MTHFR早发年龄的精神分裂症患者中的多态性,但在成人发病的精神分裂症患者中没有。每个X轴表示3的总风险等位基因数MTHFR多态位点(C677T,A1298C,G1793A)。(A)早发患者的PANSS总多态性和MTHFR多位点多态性。p<0.0001,Y=8.296X+70.71。(B)早发患者的PANSS阳性和MTHFR多位点多态性。p<0.0001,Y=4.854X+16.13。(C)早发患者的PANSS阴性和MTHFR多位点多态性。p<0.01,Y=2.397X+18.08。(D)成人发病患者的PANSS总多态性和MTHFR多位点多态性。p>0.05,Y=1.709X+13.73。(E)成人发病患者的PANSS阳性和MTHFR多位点多态性。p>0.05,Y=2.213X+61.03。(F)成人发病患者的PANSS阴性和MTHFR多位点多态性。p>0.05,Y=0.4119X+15.02。 |
症状预测分析
因此,MTHFR已经发现多态性在早发性精神分裂症患者中增加。相比之下,这组患者的症状往往比成人发病的患者更严重。我们进一步研究了发病年龄和相关代谢物(如叶酸和Hcy)与精神分裂症患者PANSS评分之间的关系。以发病年龄、叶酸和同型半胱氨酸水平为自变量,症状评分为因变量,构建多元线性回归模型分析其相互作用。结果,发病年龄越早,症状越严重,叶酸水平与早发组PANSS总分和PANSS阳性显著相关。表4显示了多种因素的相关性,包括叶酸、同型半胱氨酸、发病年龄和PANSS。之后,PANSS评分和代谢物(包括叶酸和Hcy)的单线性回归显示,在成人发病组中,叶酸水平与PANSS和PANSS阳性显著负相关。
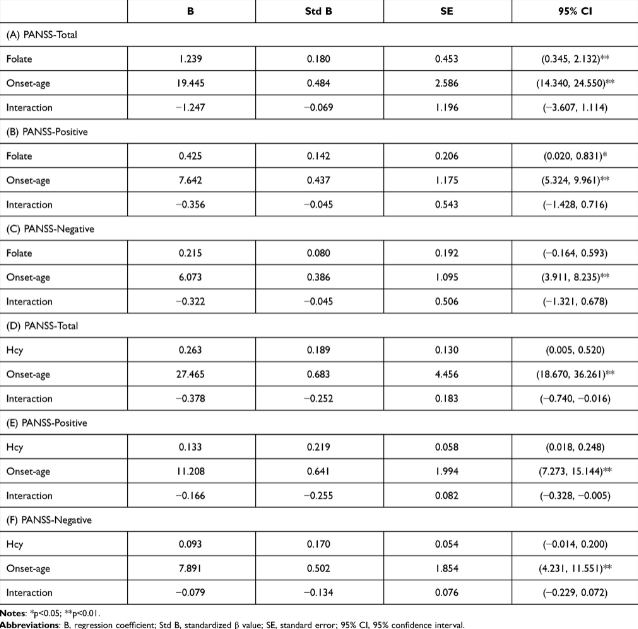
| 表4叶酸、同型半胱氨酸、发病年龄和症状的多元线性回归 |
不同发病年龄组基因组甲基化水平
甲基化预测分析
由于早发组(< 20岁)与其他组相比存在显著差异,我们将中发组(20-30岁)和成人发病组(> 30岁)与早发组结合起来进行甲基化分析。图3显示了不同发病年龄组的甲基化水平、DMPs的甲基化热图和DMP富集基因。
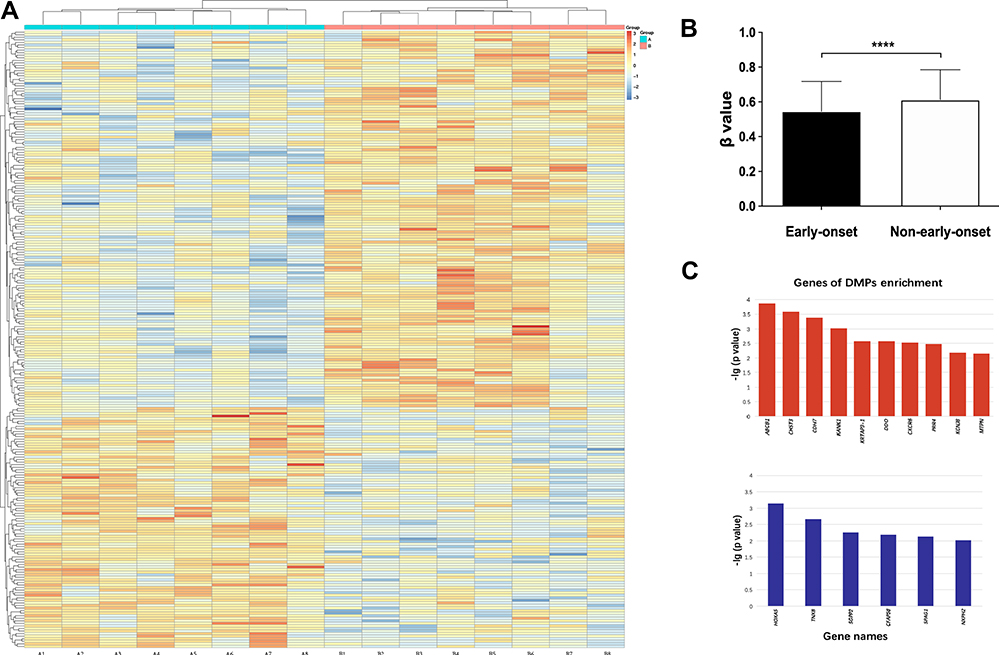
| 图3 (A)每个框代表相对于标准化转换(z分数)的β值,整合一个位置的样本的所有β值。标准化后各位置的平均值为0。每一行表示早期和成年发作的精神分裂症患者之间甲基化差异的位置,每一列表示登记的个体。(B)甲基化水平以β值测量。这些数字显示,早发性精神分裂症患者与其他人相比,具有低甲基化模式。短横条表示标准偏差。F(1,7)=4.234,***p<0.0001。(C)DMP富集的基因。上图和下图分别显示早发患者中低甲基化和高甲基化水平的DMPs富集的基因。 缩写: ABCB1,ATP结合盒,亚家族B (MDR/TAP),成员1;CHST3、软骨素6-磺基转移酶3;CDH7、钙粘蛋白7;含KANK1、KN基序和锚蛋白重复结构域的蛋白1;KRTAP3-1、角蛋白相关蛋白3-1;DDO,D-天冬氨酸氧化酶;CXCR6,C-X-C趋化因子受体6型;PRR4,脊髓灰质炎病毒受体相关4;KCNJ8钾内向整流通道亚家族J成员8;MTPN,肌营养蛋白;HOXA5,同源盒蛋白Hox-A5;TNXBXB腱生蛋白;SGPP2,鞘氨醇-1-磷酸磷酸酶2;CFAP58、纤毛和鞭毛相关蛋白58;SPAG1,精子相关抗原1;NXPH2,神经外泌素-2。 |
通过热图和方差分析,不同发病年龄患者的DMPs有显著差异(图3),这表明与对照组相比,在早发患者中发现了更多的低甲基化位点。不同发病年龄组之间的基因组甲基化水平也有显著差异。早发组和成人组的β值分别为0.55±0.17和0.62±0.19(均数±标准差)图3B),表明早发性高血压患者的基因组DNA甲基化水平明显较低。男性和女性的亚组也显示了相似的差异,即在早发患者中发现了显著的基因组低甲基化。基因组甲基化分析没有揭示任何性别特异性的影响。
差异甲基化位置
排除标准如下:非CpG,SNP相关,在X或Y染色体上的位置,和多重命中。以δβ≥0.10为标准,在不同年龄组的患者中共鉴定出2640个DMPs,其中早发受试者分别为1523个低甲基化位点和1117个高甲基化位点。DMP在热图中显示(图3A).参与DMP富集的基因显示在图3C.
GO分析
根据GO分析,确定了600个含有显著富集DMPs的基因的术语,包括多细胞生物发育和系统发育。最显著浓缩的描述性术语如所示图4。该图显示了由经典Fisher检验筛选出的分析和每个围棋类别中最重要的10个项目。基于以前的数据,术语的特征是在我们的研究中包含DMP富集的基因,并将它们标记在列的顶部。
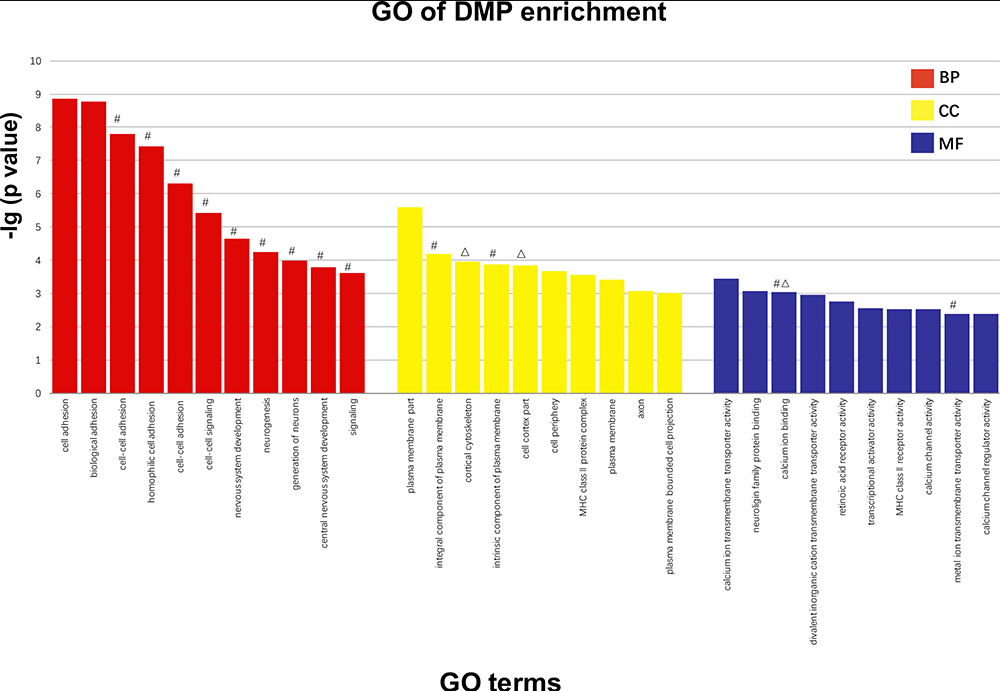
| 图4通过经典的fisher测试筛选出每类围棋中最有意义的10个项目。纵坐标越大,项目的丰富性越显著。x轴表示GO显著富集的不同项目;y轴表示对数10(DMPs的调整后p值)。#早发性精神分裂症患者DMP富集低甲基化的术语相关基因。Δ早发性精神分裂症患者DMP富集高甲基化的术语相关基因。 缩写:BP,生物过程;CC,细胞成分;MF,分子功能。 |
基因特异性DNA甲基化
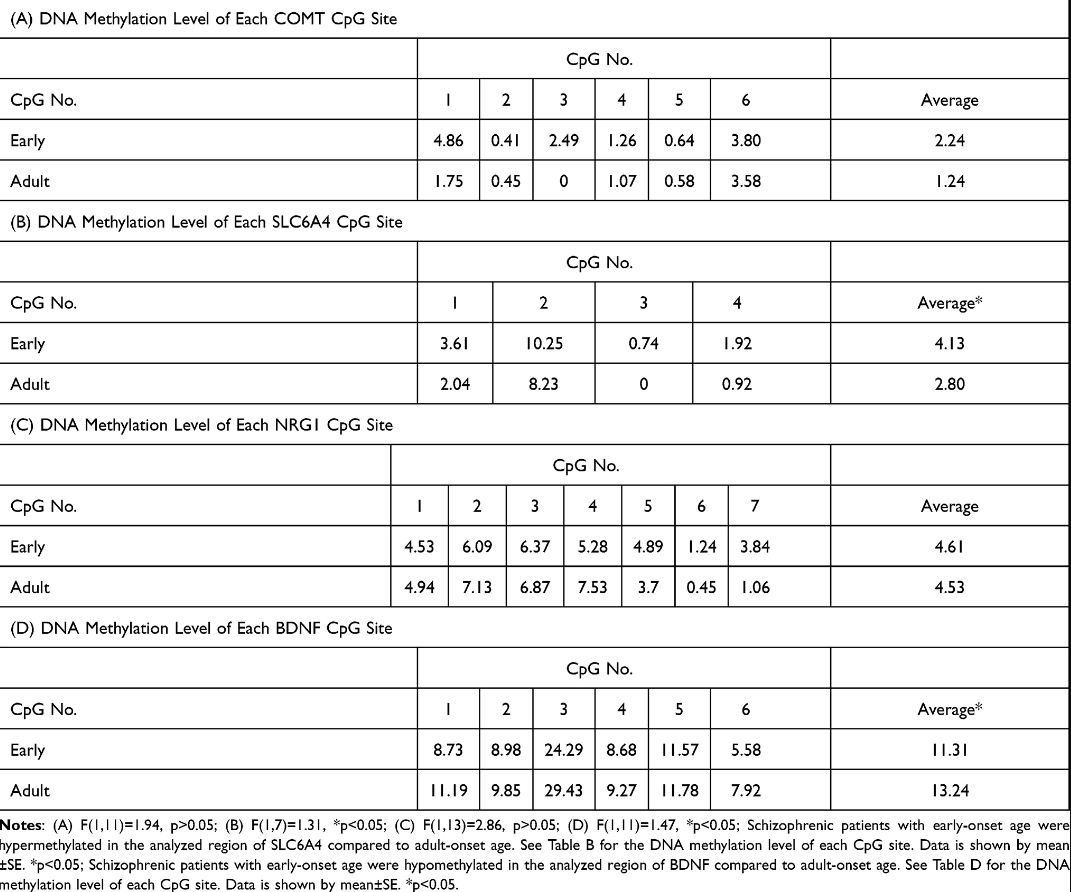
为SLC6A4四个CpG位点的平均甲基化分析表明,早发组与成年组相比存在高甲基化。为脑源性神经营养因子对六个CpG位点的类似分析发现早发组中甲基化不足。的量化儿茶酚邻位甲基转移酶和NRG1早发性和成人型精神分裂症患者的甲基化水平没有差异。表5显示了基因特异性DNA甲基化水平。
讨论
精神分裂症的发病年龄
根据文献,根据病程的临床特征,精神分裂症被分为不同的表型。除了复杂的症状,患者的发病年龄也是相关发病机制研究中的一个显著特征。如前所述,研究表明,早发性精神分裂症患者的症状很严重。20–22为了说明不同发病年龄患者的不同特征的相关机制,对皮层区域的生化代谢物的研究表明N早发性精神分裂症患者左侧背外侧前额叶皮质中的-乙酰-天冬氨酸水平显著低于健康对照组,这在成年发病患者中没有观察到。23另一项关于发病年龄的调查进一步表明d-环丝氨酸可能加重早期发病的阴性症状,支持发病年龄差异的生化基础。24对于精神分裂症的发病机制,遗传因素是促进精神分裂症患者生理和临床改变的最关键原因之一。
同时,在不同发病年龄的精神分裂症患者中的分子生物学研究没有获得不同的结果,这可能显著影响精神分裂症的表型。MTHFR是催化叶酸转化为5-甲基叶酸(5-MTHF)的必需酶,5-甲基叶酸与精神分裂症的阴性和认知症状相关。25,26的生物效应MTHFR多态性主要存在于酶活性改变和相关的下游甲基供应,这对于甲基化修饰是至关重要的。一些研究报告了表观遗传过程的甲基化与某些疾病(包括精神分裂症)的发病年龄之间的相关性。14,27
MTHFR精神分裂症的发病年龄
在我们的研究中,不同发病年龄的精神分裂症患者的PANSS评分存在显著差异,而早发患者比其他患者表现出更严重的症状。这一结果与先前的研究结果一致。28,29由于神经发育和精神分裂症发病年龄之间存在潜在联系,我们也对发育相关的一碳代谢过程感兴趣,包括MTHFR多态性、代谢物(如叶酸或Hcy)和下游甲基化修饰。基于之间的相关性MTHFR多态性与精神分裂症的不同发病年龄,这是第一项针对叶酸转换相关的MTHFR多态性和精神分裂症患者不同发病年龄分组的研究。相反,我们发现在不同发病年龄组中没有明显的单个位点的多态性效应,而多位点多态性在早发患者中显著增加。与单个位点的多态性效应相比,多位点的多态性效应更全面地决定了MTHFR的效应。然而,很少研究多位点多态性MTHFR已被发表以阐明变体的作用,这些变体与酶活性更相关,同时参与叶酸转化并直接影响甲基化过程。
考虑到症状严重程度的不同MTHFR在不同发病年龄的精神分裂症患者中,我们分析了多态性与MTHFR多态性与患者的PANSS评分。与先前相关研究的结果部分一致,18,25症状均与血压呈正相关MTHFR多位点多态性,仅在早期发病(< 20岁)的患者中观察到,而在成人发病的患者中未观察到。发病年龄可能是影响下列因素之间相关性的一个因素MTHFR和症状。总之,结果表明MTHFR在早发性精神分裂症患者的独特人群中起着潜在的作用。这一发现与先前的研究结果一致MTHFR多态性可能会加重精神分裂症的症状。25,26然而,关于早发患者上述相关性的研究很少。MTHFR在这些精神分裂症患者中的参与暗示了它在这种疾病的潜在特殊表型中的分子效应。
一碳代谢物和症状
分子机制的变化,例如MTHFR多态性与临床差异相关,包括早发性精神分裂症患者的症状恶化。由于MTHFR参与叶酸代谢,一碳代谢中相关代谢物(如叶酸和Hcy)的水平也被发现与精神分裂症和症状有关。30–32在精神分裂症患者中观察到血清叶酸水平降低,而降低的程度与使用PANSS量表测试的症状严重程度呈正相关。31此外,在精神分裂症患者中检测到Hcy水平升高。33然而,这一结论在其他已发表的研究中并不一致。34,35在本研究中,不同发病年龄的精神分裂症患者血清叶酸和同型半胱氨酸水平无显著差异。叶酸水平与症状评分呈正相关,这与以前的结果不一致。在将发病年龄作为独立因素的相互作用分析后,随后的单一线性回归表明叶酸水平和症状之间呈负相关。叶酸水平下降,这意味着叶酸转化的趋势有限,而MTHFR多态性,可能有助于精神分裂症的发展。由于早发性精神分裂症患者症状严重性的全球趋势,临床表型改变可能归因于与MTHFR和叶酸代谢相关的过程,这些过程参与了这些患者中波动的代谢途径。
除了叶酸和同型半胱氨酸之外,包括B6和B12在内的B族维生素也能有效地减轻精神症状。36–38作为一碳代谢的代谢产物,维生素B6和B12也是精神分裂症易感性的重要因素。两者都有助于缓解精神分裂症患者中普遍存在的叶酸缺乏症和高同型半胱氨酸血症。39,40那么叶酸和同型半胱氨酸可能代表了精神疾病的最终决定因素。B族维生素的影响可能涉及到它们的变化,而叶酸和同型半胱氨酸的分析可以反映出来。
潜在的甲基化效应
由于在早发性精神分裂症患者中发现了更多的特异性特征,需要更多的细节来进一步研究这种表型在人群中的潜在机制。在一碳代谢中,叶酸转化为5-MTHF,参与甲基的供应和下游的表观遗传修饰。DNA甲基化经常通过空间位阻来阻止基因表达,这可能是一种介导基因间关联的机制MTHFR多态性和精神分裂症。对于DNA甲基化,通常测量基因组和特定基因区域的水平进行评估。据报道,基因组和特定基因区域的甲基化水平可导致精神分裂症患者发生一定程度的改变。14,41在TT基因型为MTHFRC677T,基因组甲基化水平通常高于精神分裂症患者。42然而,只有少数研究报道了不同发病年龄的精神分裂症患者甲基化改变的潜在机制。在目前的研究中,早发患者的基因组甲基化水平明显低于其他发病年龄的患者,并且在早发组中发现了更多的低甲基化位点。通过选择TT基因型总数MTHFRC677T和PANSS超过60,我们认为MTHFR以精神分裂症患者的多态性和临床表型为单位,探讨其潜在机制。具有这两个特征的受试者可能反映了下游甲基供应的更显著的变化。与中/晚发病年龄相比,在早发性精神分裂症患者中,低甲基化意味着甲基化改变的潜在作用,这是由于MTHFR多态性。当纯合突变基因型的患者出现严重症状性精神分裂症时,成人发病的患者表现出相对较轻的疾病症状。基因组低甲基化通常与基因组不稳定性有关。43通过甲基化分析发现了一些生物学术语,以研究不同发病年龄的精神分裂症患者的潜在机制。在不同年龄组的患者中,超过4000个位置表现出不同的甲基化水平,这导致了他们不同的基因组DNA甲基化水平。我们还进行了GO分析,以探索影响精神分裂症发病的相关生物学过程、细胞成分和分子功能。我们选择并标记了包含具有DMP富集的先前基因的GO术语,这可以被认为是后续研究的设定点。
因为基因组甲基化可能是MTHFR影响不同发病年龄的精神分裂症的表型,可能与某些疾病相关基因的特定甲基化水平有关。血清素能神经传递在非典型抗精神病药物的作用机制中起重要作用。然后,5-羟色胺转运体的调节可以通过SLC6A4表观遗传分析。在我们的研究中,SLC6A4在早发性精神分裂症患者中,显示出显著的甲基化,这意味着潜在的下游通路。MTHFR通过血清素产生影响。相比SLC6A4表明同组中甲基化不足。这脑源性神经营养因子已经表明精神分裂症患者中甲基化水平增加,41虽然没有研究集中在甲基化改变SLC6A4或者脑源性神经营养因子在不同发病年龄的患者中。为NRG1和儿茶酚邻位甲基转移酶,尽管特定位点的甲基化水平没有显著差异,但据报道相关基因的表达与精神分裂症风险相关。44,45未来可能会有更多的样本和研究工作。因此,基因特异性甲基化改变的潜在途径MTHFR影响精神分裂症的发散性发作,并且是疾病机制的可能研究对象。
结论
早发性精神分裂症患者有更严重的症状MTHFR多态性和血清叶酸水平。在这一人群的患者中,MTHFR多态性增加,相关的基因组甲基化水平降低,这可能是该疾病病程和发病年龄相关表型的潜在机制。按照生物途径,特定基因,包括SLC6A4和脑源性神经营养因子,可能是不同可能表型的潜在研究对象。这一结果可能意味着精神分裂症的一种特殊表型,其特征是症状更加严重,增加MTHFR多态性和降低的基因组甲基化水平。该结果也将有助于精神分裂症的发病机制和临床实践的研究。
虽然有几个问题需要澄清。首先,关联研究的样本量(114对63)太小,无法进行分析,需要更大样本量的研究。第二,对于MTHFR和一碳代谢,SNP和基因表达研究可能在基础研究和临床实践的合作中很好地工作。第三,由于缺乏大样本研究,后续研究需要通过富集DMPs筛选潜在的基因和途径来探索它们在精神分裂症不同发病年龄的不同作用和可能的表型,这是更全面的。在今后的研究中,我们应该注意这些问题,并进行深入的研究。
文章来源:Wan L, Wei J. Early-Onset Schizophrenia: A Special Phenotype of the Disease Characterized by Increased MTHFR Polymorphisms and Aggravating Symptoms. Neuropsychiatr Dis Treat. 2021 Aug 3;17:2511-2525. doi: 10.2147/NDT.S320680. PMID: 34376980; PMCID: PMC8349230.